Quy trình xét nghiệm vi khuẩn nhuộm Gram
Phạm vi áp dụng của các quy trình: áp dụng cho tất cả các bệnh viện trong hệ thống Vinmec.
Người thẩm định: Đoàn Mai Phương
Người phê duyệt: Phùng Nam Lâm
Ngày phát hành: 16/05/2022
1. Mục đích xét nghiệm vi khuẩn nhuộm Gram
Nội dung bài viết
Mô tả các bước tiến hành kỹ thuật nhuộm Gram cho các bệnh phẩm và chủng vi khuẩn, vi nấm trong phòng xét nghiệm nhằm thống nhất cách thực hiện và đảm bảo chất lượng xét nghiệm giữa những người thực hiện khác nhau.
2. Phạm vi áp dụng
Quy trình này áp dụng cho mọi nhân viên Khoa Xét nghiệm, Bệnh viện đa khoa Quốc tế Vinmec.
3. Trách nhiệm
- Nhân viên được giao nhiệm vụ thực hiện xét nghiệm này tuân thủ đúng quy trình.
- Trưởng đơn nguyên, kỹ thuật viên trưởng đơn nguyên Vi sinh, trưởng tua trực chịu trách nhiệm giám sát việc tuân thủ đúng quy trình.
4. Định nghĩa – Từ viết tắt
- EQA (External Quality Assurance): Ngoại kiểm
- QC (Quality Control): Nội kiểm
5. Nguyên lý
Do sự khác biệt về cấu trúc vách tế bào nên trong quá trình nhuộm Gram, vi khuẩn Gram (+) sẽ giữ được phức hợp tím Gentian-iode mà không bị tẩy màu bởi cồn, trong khi đó vi khuẩn Gram (-) không giữ được phức hợp màu này, do vậy kết quả sau khi nhuộm là vi khuẩn Gram (+) vẫn giữ được màu tím của Gentian, còn vi khuẩn Gram (-) bắt màu hồng của Fuchsin.
6. Loại mẫu sử dụng
- Bệnh phẩm:
- Các bệnh phẩm lâm sàng, thông thường không bao gồm: dịch ngoáy họng, dịch ngoáy mũi, đờm từ bệnh nhân xơ nang phổi, chi nhân tạo. Nhuộm trực tiếp đặc biệt hữu ích trong trường hợp: mủ vết thương, tổn thương mắt, dịch vô trùng và các dịch tiết khác.
- Chai cấy máu báo dương
- Trực tiếp từ khuẩn lạc vi khuẩn, vi nấm từ môi trường nuôi cấy, tốt nhất không có chất ức chế, sau thời gian nuôi cấy 18-24h (vi khuẩn), không quá 48h (vi nấm)
- Yêu cầu:
- Tuân thủ cách lấy máu theo “Hướng dẫn thu thập, xử lý, bảo quản, vận chuyển mẫu bệnh phẩm” .
- Các mẫu sau khi lấy xong nên được vận chuyển ngay đến Khoa Xét nghiệm để tiến hành xét nghiệm để cho kết quả chính xác
7. Trang thiết bị và vật tư:
7.1. Thiết bị
- Tủ an toàn sinh học
- Kính hiển vi quang học
7.2. Vật liệu
7.2.1. Dụng cụ
- Que cấy.
- Bút chì kính.
- Đèn cồn.
- Lam kính.
- Dầu soi.
- Nước muối sinh lý (NaCl 0,9%)
7.2.2. Hoá chất
Bộ thuốc nhuộm Gram: Bio Merieux, Pháp:
- Dung dịch R1 Oxalate Crystal violet (tím gentian).
- Dung dịch R2 Stabilized Lugol-PVP.
- Dung dịch R3 Decolorizer.
- Dung dịch R4 Safranin.
- Các dung dịch này bảo quản ở 15-25℃ cho đến hạn sử dụng.
8. Chuẩn bị bệnh nhân: Không áp dụng
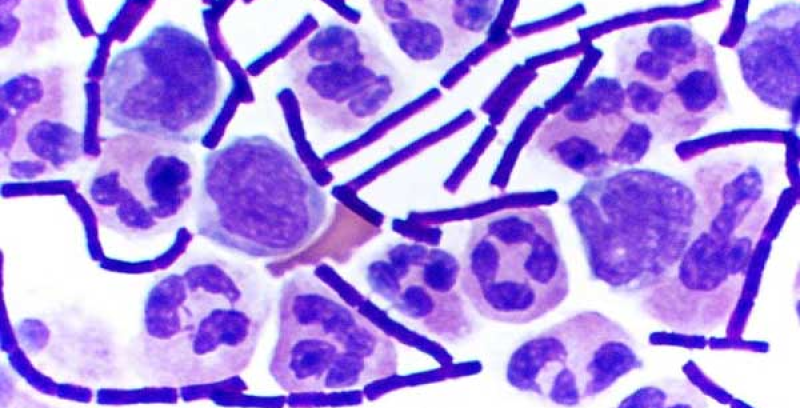
9. Quy trình xét nghiệm vi khuẩn nhuộm Gram
9.1. Chuẩn bị tiêu bản
- Lấy tiêu bản hơ trên ngọn lửa đèn cồn để tan dầu.
- Ghi tên số bệnh phẩm hoặc dán barcode lên phía đầu lam. Các bệnh phẩm lâm sàng nên được thực hiện trong tủ an toàn sinh học, bao gồm cả giai đoạn chuẩn bị lam. Khi làm việc trong tủ an toàn sinh học, tất cả nhân viên phải mặc áo choàng, đi găng và tuân thủ các quy định khác khi làm việc với tủ an toàn sinh học.
- Các loại bệnh phẩm:
- Bệnh phẩm phân: Nhỏ 1 giọt NaCl 0,9% lên lam kính khô và sạch. Dùng que cấy vô trùng lấy 1 ít bệnh phẩm hòa đều vào giọt NaCl 0,9% nhỏ sẵn, tạo 1 vùng tròn đường kính khoảng 1 cm. Để khô tự nhiên.
- Nước tiểu: Lấy 10 µl bệnh phẩm đã trộn đều, không ly tâm đặt lên lam kính, đánh dấu vị trí trên lam. Để khô tự nhên, không dàn bệnh phẩm.
- Bệnh phẩm dịch não tủy, các chất dịch vô trùng: Lắc đều ống bệnh phẩm, dùng pipet vô trùng hút và nhỏ một giọt bệnh phẩm lên lam kính, không dàn bệnh phẩm.
- Bệnh phẩm lấy bằng tăm bông: Đặt tăm bông lên lam kính, xoay nhẹ tăm bông để tránh phá hủy cấu trúc tế bào và sự sắp xếp của vi khuẩn.
- Các bệnh phẩm không lấy bằng tăm bông (dịch hút, dịch tiết, đờm, dịch phế quản…: không nên sử dụng mẫu hút bằng xi lanh vì nguy cơ phơi nhiễm bởi vật sắc nhọn cho nhân viên y tế): Dùng ăng hoặc que gỗ vô trùng lấy bệnh phẩm ở những vị trí nghi ngờ (có mủ, máu…), dàn bệnh phẩm trực tiếp lên lam kính. Trường hợp có nhiều mủ dặc, có thể nhỏ 1 giọt nước muối lên lam trước khi cho bệnh phẩm.
- Khuẩn lạc vi khuẩn, nấm:
- Nhỏ 1 giọt NaCl 0.9% lên lam kính khô và sạch.
- Dùng que cấy vô trùng lấy 1 khuẩn lạc vi khuẩn hòa đều vào nước muối nhỏ sẵn tạo 1 vùng tròn đường kính khoảng 1cm.
- Để khô tự nhiên trong tủ an toàn sinh học hoặc để trên máy sấy lam cho đến khi khô.
9.2. Cố định
- Cố định bằng nhiệt: Hơ trên ngọn lửa đèn cồn 3 lần. Mỗi lần 1 giây. Chú ý tránh hơ tiêu bản quá nóng. Để nguội.
- Hoặc cố định bằng methanol, sau đó để khô.
9.3. Nhuộm
- Để tiêu bản lên giá.
- Phủ thuốc nhuộm tím gentian (R1) lên đầy tiêu bản và để 1 phút.
- Rửa nhẹ nhàng tiêu bản dưới vòi nước chảy để loại bỏ thuốc nhuộm dư thừa.
- Phủ Lugol (R2) để khoảng 1 phút.
- Rửa tiêu bản nhẹ nhàng dưới vòi nước chảy để loại bỏ thuốc nhuộm dư thừa.
- Tẩy màu nhanh bằng cồn (R3).
- Rửa ngay tiêu bản dưới vòi nước chảy để ngừng quá trình tẩy màu.
- Phủ Fuchsin để khoảng 1 phút.
- Rửa nhẹ nhàng dưới vòi nước chảy để loại bỏ thuốc nhuộm dư thừa
9.4. Để khô tự nhiên
9.5. Soi dưới kính hiển vi
- Đánh giá chung lam nhuộm ở vật kính 10x:
- Quan sát tinh thể: nếu thấy tinh thể dư thừa, tẩy cồn và nhuộm lại hoặc chuẩn bị một tiêu bản mới.
- Xem tiêu bản đã được tẩy màu đúng không: nếu có bạch cầu, chúng sẽ bắt màu Gram âm. Nếu tiêu bản bị tẩy cồn quá mức, tẩy cồn và nhuộm lại hoặc chuẩn bị một tiêu bản mới.
- Xác định độ dày tiêu bản phù hợp không: để phiên giải đúng, các tế bào không chồng chéo lên nhau.
- Đối với tiêu bản nhuộm trực tiếp từ bệnh phẩm lâm sàng, kiểm tra 10 vi trường (cho bệnh phẩm nước tiểu), 20-40 vi trường (cho các bệnh phẩm khác) để đánh giá tình trạng viêm. Nếu có tế bào, xác định số lượng trung bình của bạch cầu đa nhân trung tính, tế bào biểu mô trong 20-40 vi trường đại diện.
- Chuyển vật kính dầu, quan sát 20-40 vi trường để đánh giá hình thể và tính chất bắt màu Gram
9.6. Lưu hủy mẫu bệnh phẩm, tiêu bản theo đúng quy định
10. Kiểm tra chất lượng
10.1. Các việc cần kiểm tra trước và sau khi thực hiện quy trình
- Thuốc nhuộm: Phải đảm bảo chất lượng và hạn sử dụng.
- Quan sát lọ chứa dung dịch thuốc nhuộm hàng ngày.
- Nếu lọ Crystal violet kết tủa hoặc lắng cặn, lọc tủa/cặn trước khi sử dụng.
- Thay đổi thường xuyên dung dịch nhuộm sử dụng hàng ngày để tránh bị cặn.
- Thuốc nhuộm bị bốc hơi có thể làm thay đổi hiệu quả của thuốc thử.
- Hạn chế tái sử dụng lọ chứa thuốc nhuộm bằng cách thay lọ thuốc nhuộm ít nhất hàng tháng.
- Thuốc nhuộm có thể bị nhiễm bẩn. Khi nghi ngờ nhiễm bẩn, sử dụng mẻ thuốc nhuộm mới
10.2. Các yêu cầu hiệu chuẩn
Hiệu chuẩn kính hiển vi theo định kỳ
10.3. Nội kiểm tra chất lượng (QC)
10.3.1.Tần suất kiểm tra chất lượng
Kiểm tra chất lượng (QC) nhuộm Gram hàng ngày và trước khi mở một lô thuốc nhuộm mới, hoặc khi nghi ngờ chất lượng thuốc nhuộm có vấn đề
10.3.2. Chuẩn bị tiêu bản
- Chuẩn bị 1 khuẩn lạc Escherichia coli ATCC 25922 và 1 khuẩn lạc Staphylococcus aureus ATCC 25923 sau khi nuôi cấy qua đêm (16-18h) theo “Hướng dẫn lưu giữ và phục hồi chủng”.
- Nhỏ 1 giọt NaCl 0,9% lên lam kính.
- Pha huyền dịch cho mỗi chủng.
- Dùng pipet Pasteur hút huyền dịch, nhỏ 1 giọt lên lam kính, dàn đều tạo 1 vùng tròn đường kính khoảng 1 cm.
- Dùng 1 ăng lấy khuẩn lạc Escherichia coli ATCC 25922 nghiền vào giọt NaCl 0,9%.
- Dùng 1 ăng khác lấy khuẩn lạc Staphylococcus aureus ATCC 25923 nghiền vào cùng giọt NaCl 0,9%.
- Để khô tự nhiên.
- Cố định bằng cách hơ qua ngọn lửa đèn cồn 3 lần, mỗi lần 1 giây.
- Nhuộm theo các bước của mục 9.3.
10.3.3. Đánh giá tiêu bản
- Đánh giá tiêu bản:
- Mật độ vi khuẩn vừa phải, đều
- Hình thể vi khuẩn rõ ràng, không bị biến dạng
- Vi khuẩn bắt mầu đúng
- Độ sạch tiêu bản không có cặn bẩn, sáng, dễ xem
- Kích cỡ tiêu bản: khoảng 1cm2
- Thời gian định kỳ kiểm tra chất lượng tiêu bản: hàng tuần.
10.3.4. Kết quả chấp nhận
- Staphylococcus aureus ATCC 25923: Cầu khuẩn Gram-dương bắt màu tím.
- Escherichia coli ATCC 25922: Trực khuẩn Gram-âm mầu hồng.
10.4. Ngoại kiểm tra chất lượng (EQA)
- Tham gia ngoại kiểm tại các Trung tâm kiểm chuẩn/phòng thí nghiệm đạt tiêu chuẩn.
11. An toàn
- Áp dụng các biện pháp an toàn chung khi xử lý mẫu và thực hiện xét nghiệm theo Chương trình an toàn phòng xét nghiệm.
- Thực hiện bảo hộ cá nhân đầy đủ khi tiếp xúc với các bệnh phẩm và tránh nhiễm chéo và không lây nhiễm cho nhân viên y tế;
- Trong trường hợp đánh đổ bệnh phẩm, phải cẩn thận làm sạch nơi bị đổ cùng với chất sát khuẩn để đảm bảo an toàn sinh học
12. Dải tuyến tính: Không áp dụng
13. Diễn giải và báo cáo kết quả
13.1. Mô tả kết quả cần đạt được
- Quan sát ở vật kính 10x: Nếu thấy bạch cầu đa nhân trung tính gợi ý phản ứng viêm. Nếu thấy nhiều tế bào biểu mô, mảnh vụn thức ăn cho thấy mẫu được thu thập không đúng. Quan sát một số hình thể đặc biệt: ký sinh trùng, nấm sợi…
- Quan sát ở vật kính 100x: hình thể, kích thước, tính chất bắt màu, cách sắp xếp của vi khuẩn, nấm.
- Vi khuẩn Gram Dương: bắt màu tím sẫm crystal violet oxalate
- Vi khuẩn Gram âm: bắt màu hồng safranine
- Vi khuẩn bắt màu không đồng đều: các vi khuẩn có hình thái giống nhau bắt màu cả Gram âm và Gram dương. Điều này có thể do tiêu bản quá dày, tẩy màu không đúng, vách bị phá hủy, hoặc do bản chất của một số vi sinh vật.
- Không bắt màu Gram: một số vi khuẩn nội bào, Mycobacterium spp, nấm…
- Đối với các lam nhuộm trực tiếp từ bệnh phẩm:
Kiểm tra ít nhất 20 đến 40 vi trường đại diện trên lam nhuộm
- Xác định số lượng tế bào trung bình dưới vật kính thấp, tế bào biểu mô vảy (SEC), bạch cầu đa nhân (PMN), hồng cầu (RBC)
- Đếm số lượng vi khuẩn và nấm dưới vật kính dầu
- Bỏ qua nếu chỉ thấy 1 hoặc 2 vi khuẩn trên toàn bộ vi trường. Báo cáo kết quả khi làm lại 1 lam khác và vẫn cho kết quả tương tự. Chỉ báo cáo nếu bệnh phẩm là dịch vô khuẩn
13.2. Báo cáo kết quả:
- Xác định số lượng tế bào dưới vật kính thấp 10x (biểu mô, bạch cầu, hồng cầu)
- 1+ (hiếm hoặc thỉnh thoảng bắt gặp): <1/vi trường
- 2+ (một vài): 1– 9/vi trường
- 3+ (tương đối nhiều): 10-25/vi trường
- 4+ (rất nhiều): >25/vi trường
- Xác định số lượng vi khuẩn và nấm dưới vật kính dầu
- 1+ (hiểm hoặc thỉnh thoảng bắt gặp): <1/vi trường
- 2+ (một vài): 1– 5/vi trường
- 3+ (tương đối nhiều): 6-30/vi trường
- 4+ (rất nhiều): >30/vi trường
- Nếu không thấy vi khuẩn, báo cáo: “ không thấy vi khuẩn”.
- Bệnh phẩm dịch âm đạo: báo cáo theo phụ lục 1.
13.3. Diễn giải kết quả về mặt lâm sàng:
- Bệnh phẩm từ vị trí vô trùng: được coi là tác nhân gây bệnh nếu quan sát thấy vi sinh vật.
- Bệnh phẩm từ vị trí có vi hệ:
- Được coi là tác nhân gây bệnh nếu quan sát thấy vi sinh vật có hình thể đặc biệt.
- Được coi là tác nhân gây bệnh khi quan sát thấy số lượng chiếm ưu thế.
14. Các yếu tố ảnh hưởng:
14.1. Các nguồn biến thiên tiềm tàng
- Kết quả nhuộm Gram không đạt yêu cầu: khi nhuộm Gram cho thấy bằng chứng chất lượng kém, kết quả nhuộm khó diễn giải, hoặc diễn giải không chính xác. Đặc điểm nhuộm xấu (ví dụ như vi khuẩn Gram dương bắt mầu nhạt, vi khuẩn Gram âm bắt mầu tím, chỉ nhuộm mép của nốt nhuộm, kết tủa trên lam, vv) có thể do chuẩn bị bệnh phẩm, thuốc nhuộm, hoặc quá trình nhuộm.
- Khả năng phát hiện:
- Cần 104 (tế bào đã ly tâm) đến 105 vi khuẩn/ml của dịch chưa ly tâm để có thể nhìn thấy vi khuẩn trên lam nhuộm
- Ở nồng độ thấp hơn, sẽ không nhìn thấy vi khuẩn trên lam nhuộm mặc dù nuôi cấy dương tính
- Vi khuẩn không mọc trên môi trường nuôi cấy nhưng lại nhìn thấy trên lam nhuộm Gram thường là các vi khuẩn khó mọc hoặc kỵ khí cần các điều kiện nuôi cấy và môi thường đặc biệt.
- Các nguyên nhân dẫn đến đọc kết quả sai, làm cho vi khuẩn Gram (-) chuyển thành Gram (+) (Gram dương giả):
- Phết vi khuẩn quá dày làm cho cồn không thể tẩy mầu toàn bộ vi khuẩn trong tiêu bản nhuộm;
- Tẩy cồn trong thời gian quá ngắn hay dung dịch cồn bị pha quá loãng làm cho màu Gram không được đẩy khỏi tế bào vi khuẩn.
- Các nguyên nhân dẫn đến đọc kết quả sai, làm cho vi khuẩn Gram (+) chuyển thành Gram (-) (Gram âm giả):
- Tuổi của mẫu cấy vi khuẩn ảnh hưởng đến tính chất nhuộm Gram ở các mẫu cấy vi khuẩn để thời gian quá 24 giờ;
- Dung dịch lugol không còn tốt nữa do quá lâu và mất đi iodine;
- Tẩy cồn quá lâu hoặc dùng nhầm chai tẩy màu của phương pháp nhuộm kháng acid và tráng không kỹ.
- Sai sót khác: sau khi phủ dung dịch tím gentian, không rửa sạch màu thừa trên lam kính, sau đó phủ lugol trên tiêu bản thì màu của tím gentian thừa sẽ bị tủa lại bám trên bề mặt tiêu bản. Kết quả khi quan sát qua kính hiển vi sẽ thấy rất nhiều tinh thể tím gentian bám trên tiêu bản làm lầm tưởng hình ảnh vi nấm.
14.2. Các chú ý để đảm bảo tốt kết quả của quy trình
Tiến hành khắc phục bằng cách thiết lập một hệ thống để xem xét báo cáo kết quả nhuộm Gram:
- Nhân viên giám sát xem xét các tiêu bản nhuộm Gram để xác định nhu cầu đào tạo và để hỗ trợ lâm sàng phù hợp.
- Hàng năm, khoa xét nghiệm tổ chức đánh giá độ tương đồng trong việc đọc kết quả hình thể vi sinh vật giữa các nhân viên. Mục đích: đảm bảo mô tả hình thể vi sinh vật được nhất quán giữa tất cả các nhân viên thực hiện nhuộm soi. Cách thực hiện: Sử dụng một bộ vi sinh vật đã xác định trước về hình thể, bao gồm cả vi khuẩn, vi nấm (có thể sử dụng chủng ATCC, chủng ngoại kiểm). Các nhân viên tiến hành nhuộm Gram và đánh giá kết quả. Ghi chép kết quả tổng hợp vào “Biểu mẫu đánh giá sự tương đồng trong việc đọc kết quả nhuộm Gram” (BM.02/QX.VS.001).
- So sánh kết quả nuôi cấy cuối cùng với kết quả nhuộm Gram để kiểm tra hình thái VSV có trên tiêu bản nhuộm Gram nhưng nuôi cấy không mọc. Tương tự như vậy, xem xét tất cả các trường hợp nuôi cấy định lượng 3(+) đến 4(+) khi nuôi cấy nhưng nhuộm Gram không phát hiện được.
- LƯU Ý: Một số lớn các vi sinh vật quan sát được trên tiêu bản nhuộm Gram có thể nuôi cấy được. Điều tra sự khác biệt để phát hiện lỗi khi nhuộm để đánh giá hoặc chỉ định nuôi cấy thêm
15. Lưu trữ hồ sơ: Ghi chép rõ ràng kết quả vào hệ thống mạng Labconn
Sơ đồ quy trình xét nghiệm vi khuẩn, vi nấm nhuộm gram Phụ lục 1 Báo cáo kết quả nhuộm Gram bệnh phẩm dịch âm đạo
16. Tài liệu liên quan:
- Biểu mẫu QC nhuộm Gram
- Biểu mẫu đánh giá sự tương đồng trong việc đọc kết quả nhuộm Gram
- Phiếu theo dõi cấy chuyển chủng ATCC
- Hướng dẫn sử dụng kính hiển vi quang học
- Hướng dẫn lưu giữ và phục hồi chủng
- Hướng dẫn thu thập, xử lý, bảo quản, vận chuyển mẫu bệnh phẩm
- Quy trình lưu và hủy bệnh phẩm sau xét nghiệm
17. Tài liệu tham khảo
- Bio Merieux, Color Gram 2 (COLOR GRAM 2 – F) Staining of microorganisms – package instruction, 2015
- ASM Clinical Microbiology Procedures Handbook, 4th Edition, 2016
- Xét nghiệm vi sinh lâm sàng, Nhà xuất bản Y học, 2012.
Bản quyền và thương hiệu: Thông tin và hình ảnh trên website thuộc quyền sở hữu của VinmecDr. Việc sao chép, sử dụng phải được VinmecDr chấp thuận trước bằng văn bản.
Miễn trừ trách nhiệm: Tất cả những tư liệu được cung cấp trên website này đều mang tính tham khảo. Do đó, nội dung và hình ảnh sẽ được thay đổi, cập nhật và cải tiến thường xuyên mà không phải thông báo trước. VinmecDr không bảo đảm về độ chính xác cũng như sự hoàn thiện về thông tin. Chúng tôi không chịu trách nhiệm pháp lý cho những thiệt hại xuất hiện trực tiếp hay gián tiếp từ việc sử dụng hoặc hành động dựa theo những thông tin trên hoặc một số thông tin xuất hiện trên website này. VinmecDr không chịu trách nhiệm pháp lý về những sai sót, lỗi chính tả… do nhập liệu cùng với những sự cố khách quan khác như: nhiễm virus, hành vi phá hoại, ác ý… xảy ra trên website này cũng như các website liên kết, nếu có.
Đường link liên kết VinmecDr sẽ không chịu trách nhiệm hay có nghĩa vụ pháp lý dưới bất kỳ hình thức nào về nội dung của những website không thuộc VinmecDr được liên kết với website www.vinmecdr.com, bao gồm các sản phẩm, dịch vụ và những mặt hàng khác được giới thiệu thông qua những website đó